Die –N=C=O-Gruppe, auch als Isocyanatgruppe bekannt, ist eine funktionelle Gruppe in der organischen Chemie und spielt eine wichtige Rolle in zahlreichen chemischen Reaktionen und Verbindungen. Die Isocyanatgruppe besteht aus einem Stickstoffatom (N), einem zentralen Kohlenstoffatom (C) und einem Sauerstoffatom (O), die linear miteinander verbunden sind. Dabei bildet das zentrale Kohlenstoffatom jeweils eine Doppelbindung zum Stickstoffatom sowie zum Sauerstoffatom:
N=C=O
- Stickstoff (N) hat 5 Valenzelektronen und geht mit dem Kohlenstoffatom eine Doppelbindung ein.
- Kohlenstoff (C) hat 4 Valenzelektronen und bildet je eine Doppelbindung zu Stickstoff und Sauerstoff.
- Sauerstoff (O) besitzt 6 Valenzelektronen und bildet ebenfalls eine Doppelbindung zum Kohlenstoff.
Insgesamt teilt jedes der beteiligten Atome jeweils zwei Elektronen pro Doppelbindung, sodass zwei stabile Doppelbindungen entstehen (N=C und C=O).
In der Isocyanatgruppe teilt das Stickstoffatom (N) drei seiner Valenzelektronen mit dem Kohlenstoffatom (C), um eine Einfachbindung zu bilden. Das Kohlenstoffatom (C) teilt zwei seiner Valenzelektronen mit dem Stickstoffatom (N) und zwei weitere Valenzelektronen mit dem Sauerstoffatom (O), um eine Dreifachbindung zu bilden. Das Sauerstoffatom (O) teilt zwei seiner Valenzelektronen mit dem Kohlenstoffatom (C).
Elektronegativität ist ein Maß dafür, wie stark ein Atom Elektronen in einer chemischen Bindung anzieht. Hier sind die Elektronegativitätswerte für Stickstoff, Kohlenstoff und Sauerstoff nach der Pauling-Skala:
- Stickstoff (N): 3,04
- Kohlenstoff (C): 2,55
- Sauerstoff (O): 3,44
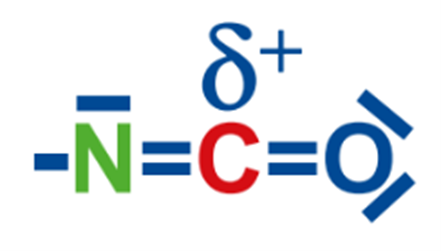
Die Elektronegativitätsunterschiede in der Isocyanatgruppe sind:
- N-C-Bindung: 3,04 (N) – 2,55 (C) = 0,49
- C-O-Bindung: 3,44 (O) – 2,55 (C) = 0,89
Da die Elektronegativitätsunterschiede in diesen Bindungen relativ gering sind, sind die Bindungen in der Isocyanatgruppe überwiegend kovalent. Der Elektronegativitätsunterschied in der C-O-Bindung ist jedoch größer als in der N-C-Bindung, was bedeutet, dass die C-O-Bindung eine größere Polarisierung aufweist. Diese Polarisierung macht das Kohlenstoffatom (C) in der Isocyanatgruppe zu einem Elektrophiliezentrum, das für nucleophile Angriffe anfällig ist.
Einige der wichtigsten Reaktionen, an denen die Isocyanatgruppe beteiligt ist, sind:
- Hydrolyse: Isocyanate reagieren mit Wasser (H2O) unter Bildung von Kohlendioxid (CO2) und primären Aminen. Diese Reaktion ist exotherm und führt zur Freisetzung von Wärme.
- Reaktion mit Alkoholen: Isocyanate reagieren mit Alkoholen zur Bildung von Harnstoffderivaten, die in der Herstellung von Polyurethanschaum und anderen Materialien verwendet werden.
- Reaktion mit Aminen: Isocyanate reagieren mit primären und sekundären Aminen zur Bildung von Harnstoffderivaten und Urethanen. Diese Reaktionen sind in der Herstellung von Polyurethanen, Farben, Lacken und Klebstoffen von Bedeutung.
- Dimerisierung und Trimerisierung: Isocyanate können unter geeigneten Bedingungen dimerisieren und trimerisieren, um cyclische Harnstoffderivate oder Isocyanuratringe zu bilden. Diese Reaktionen sind in der Herstellung von Spezialpolymeren und feuerfesten Materialien relevant.
Insgesamt ist die -N=C=O Gruppe aufgrund ihrer Reaktivität und vielfältigen Reaktionsmöglichkeiten in der organischen Chemie von großer Bedeutung. Die unterschiedlichen Reaktionen der Isocyanatgruppe ermöglichen die Herstellung verschiedener Materialien und Produkte, die in vielen Industrien weit verbreitet sind.
Hier ist eine Tabelle mit einigen der Fachbegriffe aus der vorherigen Antwort und deren Erklärungen:
| Fachbegriff | Erklärung |
| Isocyanatgruppe | Eine funktionelle Gruppe in der organischen Chemie, bestehend aus einem Stickstoff-, Kohlenstoff- und Sauerstoffatom (-N=C=O). |
| Elektrophiliezentrum | Ein Atom oder Bereich eines Moleküls, der aufgrund einer positiven Teilladung anfällig für Angriffe von Nucleophilen ist. |
| Nucleophil | Ein Reaktionspartner, der Elektronenpaare spendet und somit elektrophile Zentren in Molekülen angreift. |
| Hydrolyse | Eine chemische Reaktion, bei der eine Verbindung in Anwesenheit von Wasser in zwei oder mehr Teile zerlegt wird. |
| Harnstoffderivate | Chemische Verbindungen, die von Harnstoff abgeleitet sind und in der Herstellung von Polyurethanen, Farben, Lacken und Klebstoffen verwendet werden. |
| Polyurethane | Eine Klasse von Polymeren, die aus der Reaktion von Isocyanaten und Polyolen entstehen und in Schaumstoffen, Farben, Lacken und Klebstoffen verwendet werden. |
| Urethane | Chemische Verbindungen, die eine Carbamat-Gruppe (-NHCOO-) enthalten und in der Herstellung von Kunststoffen, Lacken und Klebstoffen verwendet werden. |
| Dimerisierung | Eine Reaktion, bei der zwei Moleküle der gleichen Art zu einem größeren Molekül verbunden werden. |
| Trimerisierung | Eine Reaktion, bei der drei Moleküle der gleichen Art zu einem größeren Molekül verbunden werden. |
| Isocyanuratringe | Chemische Strukturen, die durch Trimerisierung von Isocyanaten entstehen und in der Herstellung von Spezialpolymeren und feuerfesten Materialien verwendet werden. |






